14/14 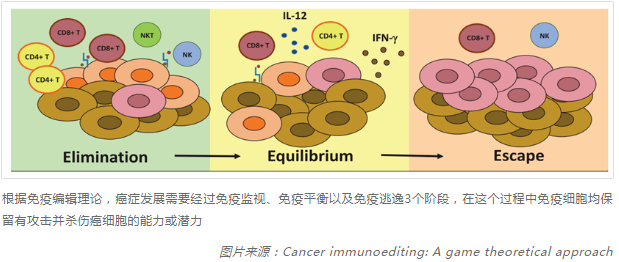 2/14
2/14
文章来源:沙利文公众号
根据美国癌症治疗数据显示,美国胆管癌患者的总体5年生存率只有5%~15%,临床治疗手段有限。2019年12月1日,美国患者梅琳达(Melinda Bachini)被诊断为胆管癌,在接受手术、化疗后一段时间内癌症进展得到遏制,但最终因化疗不耐受停止治疗后癌症复发。2012年,Melinda在被诊断为仅剩几个月生命时加入Steven Rosenberg博士团队主导的肿瘤浸润淋巴细胞(Tumor Infiltrating Lymphocytes,TIL)治疗临床试验中。在接受TIL疗法治疗后,梅琳达最终获得临床治愈,并存活至今。
20世纪50年代TIL疗法先驱Steven Rosenberg博士便已经开始探索移植物抗肿瘤反应以及T淋巴细胞(T lymphocyte)在抗肿瘤中的应用,于1982年和来自美国国立卫生研究院(National Institutes of Health,NIH)的同事首次从小鼠模型中分离出TIL细胞,并证明了TIL在小鼠肿瘤模型中显著的治疗效果,又于1988年首次报道了TIL疗法在黑色素瘤病人中的临床试验。此后经历数十年,TIL疗法的治疗效果逐渐得到认可并被认为是治疗实体瘤的一种有效手段。
2022年4月,由沙砾生物科技有限公司(下称“沙砾生物”)自主研发生产的TIL疗法治疗产品GT101注射液(受理号CXSL2200061)正式获得国家药品监督管理局(Nation Medical Products Administration,NMPA)的临床试验默示许可,成为中国首个进入临床的TIL 产品,正式开启TIL疗法中国临床试验征程。
根据免疫编辑理论,在肿瘤发展的过程中,人体内的免疫细胞始终会针对肿瘤细胞发挥杀伤作用,不同的免疫细胞(主要是淋巴细胞)经过运输抵达肿瘤部位,这些已经浸润到肿瘤组织并发挥杀伤作用的淋巴细胞即肿瘤浸润淋巴细胞,包括T细胞、B细胞、NK细胞、巨噬细胞等多种单核和多核免疫细胞,可以对肿瘤起到识别、抵抗、攻击和杀灭作用。
图一 免疫编辑理论
TIL疗法属于细胞免疫治疗(Cellular Immunotherapy)的一种,细胞免疫治疗是一种应用活化增殖或进行基因工程编辑的免疫细胞进行治疗的方法,其主要步骤包括从肿瘤患者体内分离出特定的免疫活性细胞(包括T细胞、NK细胞、DC细胞以及巨噬细胞等)、在体外进行基因修饰或扩增、功能鉴定、最后回输治疗等过程。
TIL疗法是指从肿瘤组织中分离出肿瘤浸润淋巴细胞,在体外进行培养并大量扩增后再回输到人体后进行治疗的疗法。TIL疗法的主要常规步骤包括:
-
① 获取病人肿瘤组织:主要是通过手术或活检获取患者的肿瘤组织,肿瘤组织中会包括TIL细胞;
-
② 切碎肿瘤组织:通过这一步骤可以让T淋巴细胞更容易从肿瘤组织中生长扩增;
-
③ 添加白细胞介素(Interleukin 2,IL-2)培养:在加入高浓度的IL-2后,一方面为原有的TIL细胞提供存活信号,同时刺激其发生更大规模的扩增;
-
④ 进行肿瘤特异性识别检测:通过对TIL细胞进行肿瘤特异性识别检测,筛选能够对肿瘤更具特异性杀伤的TIL制备工艺,以保证治疗效果;
-
⑤ 扩增后TIL细胞回输治疗:将扩增、筛选后的TIL细胞回输进患者体内,达到治疗目的。
图二 TIL疗法治疗步骤
目前细胞治疗领域引起广泛关注、较为主流的疗法包括TIL疗法、CAR-T(Chimeric Antigen Receptor T cell)疗法、TCR-T细胞(T Cell Receptor)疗法、CAR-NK细胞(Chimeric Antigen Receptor Natural Killer Cell,CAR-NK)疗法等,主要应用于肿瘤治疗领域,不同的疗法在肿瘤治疗中也有着各自的优势。
图三 主要细胞免疫治疗细胞来源、应用领域以及治疗优势
1、实体瘤细胞疗法百舸争流 TIL疗法获FDA突破性疗法认证
实体瘤治疗形势严峻,细胞免疫治疗纷纷入局
肿瘤已经成为当今世界人类预期寿命增长的最大阻碍因素之一,仅次于心血管疾病。根据世界卫生组织旗下癌症研究机构(International Agency for Research on Cancer,IARC)数据显示,2020年全球新发癌症病例数近2,000万,死亡病例数接近1,000万,不论是新发癌症病例数还是死亡病例数,实体瘤患者的占比均超过90%。
图四 2020年全球癌症新发及死亡病例数
最近数十年,肿瘤治疗方式飞速发展,治疗手段也在不断增加,现如今已经发展出手术、放化疗、靶向药以及新一代的免疫治疗方法。从原理上来说,免疫治疗方法和手术、放化疗以及靶向药有着本质的区别:免疫疗法是基于人体免疫系统自身的能力,通过解除免疫细胞受到的抑制或增强免疫细胞的数目及肿瘤的识别和杀伤能力,进而推动人体自身的免疫系统攻击并消灭肿瘤,区别于手术、放化疗以及靶向药直接针对肿瘤发挥作用的机制。时至今日,细胞免疫治疗作为免疫治疗中的重要一支,正在成为对抗实体瘤的一个重要治疗方式。
2017年,全球首款CAR-T细胞治疗产品获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市,开启了CAR-T细胞疗法治疗血液瘤征程,并迅速带动细胞免疫治疗相关临床试验开展。最初开展的细胞免疫治疗临床试验适应症多为血液瘤,近些年来,细胞免疫治疗适应症开始逐渐向实体瘤治疗方向靠拢。
从2020年开始,肿瘤治疗相关领域免疫细胞治疗临床试验数量逐渐增加,从2020年的233项增加到2022年的314项,增长达到24.7%。血液瘤临床试验数量占比逐渐降低,实体瘤临床试验数量占比不断提高,从2020年的不到30%,提升至2022年的接近45%,通过细胞免疫疗法治疗实体瘤正在成为肿瘤治疗领域的一个重要发展方向。
与此同时,在针对实体瘤治疗的临床试验治疗中,多种细胞免疫治疗数量均在不断增加,整体细胞免疫治疗数量从2020年的66项增加到2022年的140项,增长幅度超过110%。在这一过程中,TIL疗法的临床试验管线增加比例最为明显,在整体实体瘤细胞免疫治疗的占比从4.5%增加到17.1%,正在成为探索并治疗实体瘤的一个新治疗趋势,TIL疗法在实体瘤治疗领域的潜力正在吸引更多研究者和企业入局。
图五 2020年至2022年实体瘤不同细胞免疫治疗临床试验数量及占比变化
实体瘤治疗区别于血液瘤,需要解决多种难点
细胞免疫治疗进军实体瘤治疗是行业趋势。作为现今对人类威胁最大的几种疾病之一,实体瘤治疗仍旧存在诸多挑战,细胞免疫治疗现需要针对难点突围,才有望打破现今实体瘤治疗困局。
主要难点一:如何打破实体瘤肿瘤微环境
和血液瘤相比,实体瘤治疗目前最大的难点之一在于实体瘤会构建适合肿瘤生存而抑制免疫细胞发挥作用的微环境,即肿瘤微环境(Tumor microenvironment, TME)。根据研究显示,TME表现出低pH、低氧、高渗透性以及免疫抑制等特点,TME中存在的免疫抑制类型细胞(包括调节性T细胞(Treg)、骨髓来源异质性细胞(myeloid derived suppressor cells,MDSC)以及部分巨噬细胞),同时免疫抑制类型细胞也会分泌对应的细胞因子,共同抑制正常免疫细胞发挥作用。如何打破肿瘤免疫微环境,是细胞免疫治疗发挥作用的关键难点之一。
图六 肿瘤微环境带来的挑战与机遇
主要难点二:如何精准定位并攻击实体瘤
在针对肿瘤进行治疗时,我们需要让药物精准靶向肿瘤细胞,同时避免药物攻击正常细胞,这就需要找到肿瘤细胞的特异性抗原(Tumor Specific Antigen,TSA)——即只在肿瘤细胞上表达但是在正常细胞上不表达的抗原。随着细胞测序技术的发展,目前人们已经可以从更多种类的抗原中进行筛选,但是需要精准找到特定肿瘤细胞的TSA仍旧任重而道远。TIL疗法的优势之一在于其本身就是从肿瘤部位获取,具备识别多个肿瘤抗原的TCR克隆,因此对于肿瘤细胞有着更强的特异性,也可以更好地解决实体瘤抗原的异质性问题。
主要难点三:如何让免疫细胞抵达并浸润实体瘤
细胞免疫治疗是通过将免疫细胞回输到血液中之后随着血液流动到达对应部位,血液瘤由于多数肿瘤细胞就在血液中,因此可以较为轻易地接触并发挥作用,但是实体瘤位于身体的具体某个部位,因此回输的免疫细胞需要经过较长的运输才能到肿瘤部位,这会降低治疗效果;而到达肿瘤部位时,回输的免疫细胞仍旧需要浸润到肿瘤组织中,进而才可以发挥治疗作用。在这一方面,TIL细胞同样具有天然的优势,因为TIL细胞本身来源于肿瘤组织,其天然的趋化因子表达受体谱使得TIL具有更强的趋化性和浸润能力。
主要难点四:如何应对T细胞耗竭
T细胞是免疫系统中主导细胞免疫反应的细胞,也是免疫细胞抗肿瘤反应中的重要细胞类型。随着近年来对于免疫细胞抗肿瘤反应研究的深入,当T细胞在肿瘤微环境中长期受到肿瘤抗原刺激或/和处于免疫抑制的情况下,会进入到一种称为“T细胞耗竭(T Cell Exhaustion)”的状态,耗竭T细胞会失去应有的效用功能,多种抑制性受体持续性高表达,同时转录因子表达以及细胞代谢均会发生改变。通过对T细胞产品培养工艺的不断优化或者进行基因编辑增强其抗耗竭能力,是应对T细胞耗竭的重要方式之一。
图七 T细胞耗竭
寻找破局之路,细胞疗法制定不同攻克实体瘤策略
临床上为更好地针对实体瘤治疗,包括CAR-T疗法、CAR-NK细胞疗法、TCR-T细胞疗法以及TIL疗法均在探索不同的道路、制定不同的应对策略,以提升实体瘤治疗效果:
图八 主要细胞免疫疗法实体瘤挑战以及治疗策略
TIL疗法获得FDA突破性疗法认证,率先取得突破
和其他疗法不同的是,TIL疗法在实体瘤治疗中有着天然的优势,具有肿瘤特异性靶点丰富、肿瘤趋向性好、浸润能力强和副作用小等优点。
-
肿瘤特异性靶点丰富——TIL细胞天然浸润在肿瘤部位,天然具有可识别多种肿瘤特异性抗原的TCR克隆,因此在培养扩增后可以识别和靶向多种肿瘤抗原,进而克服肿瘤异质性问题,实现广谱杀伤癌细胞作用;
-
肿瘤趋向性好、浸润能力强——TIL细胞之前成功浸润到肿瘤组织中,具有较外周血T细胞更为相关的趋化因子表达谱,因此在回输进入人体后会被肿瘤相关趋化因子吸引进而更好地达到并浸润肿瘤组织;
-
安全性高,细胞毒性小——TIL细胞是人体肿瘤组织中已有的免疫细胞,在早期胸腺发育过程中经过了筛选,因此回输后不会对其他人体自身细胞发挥杀伤作用,安全性高。TIL疗法发展至今未观察到因为TIL细胞回输引发的任何重大副作用。
因此TIL疗法被认为是当前实体瘤领域最具竞争力以及产业化潜力的免疫治疗方式之一。
2019年5月,由Iovance Biotherapeutics公司开发的TIL疗法LN-145(Lifileucel)率先获得FDA突破性疗法认证,用于治疗在接受化疗后复发、转移性或持久性宫颈癌,这为细胞免疫治疗进军实体瘤吹响了冲锋的号角。
2、TIL疗法方兴未艾 国内企业积极探索应对治疗挑战
TIL疗法发展至今,突破不断助力攻克实体瘤
自20世纪80年代,Steven Rosenberg博士团队首次证实TIL疗法可以抑制黑色素瘤患者体内肿瘤细胞转移开始,TIL疗法开始迅速发展,尤其是近十几年,TIL疗法在实体瘤治疗领域不断取得突破性进展:
-
1988年,Rosenberg / NCI在NEJM首次报道应用TIL治疗黑色素瘤病人;
-
2011年,Rosenberg / NCI报道黑色素瘤病人获得56% ORR, 24% CR;
-
2012年,Melinda Bachini成为首位接受TIL疗法治疗后完全缓解的胆管癌患者,并存活至今;
-
2016年,Steven Rosenberg博士团队首次从肺转移肿瘤患者中分离出靶向新抗原的TIL细胞,患者在接受TIL细胞治疗后肿瘤消退;
-
2019年,美国FDA授予TIL疗法LN-145突破性疗法认证,这是免疫细胞治疗实体瘤领域首次获得这一认证;
-
2023年5月,美国FDA受理TIL细胞疗法LN-145生物制品许可申请,并授予其优先评审许可。
图九 TIL细胞及TIL疗法发展重要事件
根据预测,2023年全球有望迎来首款个性化、一次性给药治疗实体瘤的TIL细胞疗法上市,这将极大地推动TIL疗法以及细胞免疫治疗领域的发展。
寻求突破,解决TIL研发、产业化挑战成企业突围重点
TIL疗法是根据患者自身细胞来源进行的一种高度定制化的精准细胞疗法,在实体瘤治疗效果上获得了广泛的认可。全球范围内TIL疗法仍旧在研发以及探索产业化的道路,对于中国企业而言,在TIL疗法赛道上,如何更好地应对研发和产业化道路上的问题,将成为企业能否突围的关键所在。
主要挑战一:如何制备更有效力的TIL细胞
T细胞是TIL细胞中最主要的一类发挥作用的细胞,一方面T细胞可以用于结合肿瘤细胞的TCR的多样性十分重要,只有有效识别肿瘤细胞,才能更好地发挥作用;另一方面实体瘤中T细胞也会面临T细胞耗竭的困局,如何让T细胞恢复功能也是关键所在。
针对这一挑战,沙砾生物构建了3大具体技术平台:通过丰富的肿瘤和外周血样本资源搭建肿瘤特异性TCR追踪平台,以实现高通量肿瘤抗原特异性TCR发现并指导TIL培养工艺优化;基于TIL细胞特性进行全基因组靶点筛选,并通过体内体外多轮功能验证发现可全面提升TIL细胞的存活率和效力的靶点;通过搭建的基因敲除系统,实现高效精准的TIL细胞编辑,进一步提升TIL疗法的治疗效果。这三个用于筛选和制造更高效力TIL细胞的平台被命名为TST hunter®高通量TCR发现平台、ImmuTFinder®T细胞靶点高通量筛选平台以及KOReTIL®高效TIL基因敲除体系平台。
主要挑战二:实现TIL细胞的高效快速扩增及制备
TIL疗法用于临床治疗研究,满足治疗的高效快速扩增是关键需求之一。接受治疗的患者往往疾病进展迅速,需要在较短时间内接受治疗,这就要求在一定时间内将获取的TIL细胞扩增到治疗用量。
目前TIL疗法从获取到制备的普遍时间在1个月左右,Iovance公司的生产技术可以将TIL细胞的制备时间缩短到22天。在这一方面,沙砾生物也实现了突破,其搭建的干性平台StemTexp®同样实现了TIL细胞的快速扩增,基于其自主IP的生产工艺,可以在22天左右将获取的TIL细胞数量扩增到临床治疗剂量;并具有更佳的记忆细胞表型,意味着在体内良好的存续和疗效。目前沙砾生物已经在15个适应症中完成了相关工艺验证,制备成功率超过90%。
主要挑战三:降低TIL细胞疗法的制备成本
细胞疗法的治疗定价普遍昂贵,以上市的CAR-T细胞疗法为例,其在国外的定价均超过200万人民币,国内已经上市的CAR-T细胞疗法定价也均超过100万人民币。降低患者的治疗成本,则需要对TIL疗法的整体制备过程进行优化,降低制备流程中的技术成本。
沙砾生物在TIL疗法制备以及产业化方面也进行了进一步探索。在TIL疗法制备方面,沙砾生物产业化方面进行积极探索,同医院、研究机构达成深度合作,已完整打通产业链条,进一步降低TIL疗法的制备时间以及治疗成本。
同时在下一代TIL疗法的制备上, 沙砾生物已打造了高效编辑T细胞平台StaViral®,是为TIL疗法量身定制的逆转录病毒系统,通过独有的优化方案可以提高转导效率并降低治疗成本,并经过CAR-T产品的注册临床试验验证。其可以在TIL制备中实现稳定高效转导,相较于传统的质粒转染方法可降低90%成本。
政策加持、借力资本,推动TIL疗法产品上市
国内细胞治疗领域政策密集出台,推动行业发展
2016年“魏则西事件”的发生为细胞疗法行业发展敲响了一记警钟,国家在此之后密集出台细胞治疗相关政策。伴随着2017年全球首款CAR-T细胞疗法的上市,中国细胞治疗领域也于2017年底迎来了重磅政策《细胞治疗产品研究与评价技术指导原则(试行)》,在这项文件中以规范和指导按照药品研发及注册的细胞治疗产品的研究与评价工作,为细胞疗法上市指明了方向。此后伴随着细胞治疗领域众多政策的出炉,推动了中国细胞疗法的进展,TIL疗法类型的创新性疗法在政策引领下快速发展。
图十 2017年至2023年7月中国细胞免疫治疗领域政策盘点
资本助力,融资火热,TIL疗法赛道投资高涨
近些年来,全球范围内TIL疗法赛道投资十分火热,多家公司获得超亿元投资。在国内,自2017年以来,TIL疗法赛道融资超过30起,并且大多数融资发生在2020年后,随着TIL疗法进入到临床并且临床数据得到不断披露,效果也进一步得到验证,也极大地鼓舞了市场以及投资者的信心。
图十一 中国TIL疗法行业公司投融资情况
根据数据显示,目前国内已经获得融资并且金额超过亿元的公司包括沙砾生物、君赛生物、卡替医疗、森朗生物、天科雅、西比曼以及原启生物等,其中沙砾生物不仅是国内第一家TIL细胞治疗产品进入临床的公司,后续也有更多新型TIL管线进入到临床。国内TIL疗法临床试验探索方向并不相同,目标适应症包括黑色素瘤、宫颈癌、肺癌、消化道肿瘤、妇科肿瘤等,多样且丰富的适应症研发策略将为国内企业产品上市提供广阔路径。
图十二 中国TIL疗法公司获批产品情况
展望未来,下一代TIL疗法为实体瘤带来更多治疗希望
现在的TIL疗法已经在实体瘤临床试验中已经展现出了强大的治疗潜力,不过其治疗反应率仍旧有进一步提升的空间,这也是下一代TIL疗法聚焦的核心点,针对现存TIL疗法的存在的一些挑战,下一代TIL疗法主要从提高肿瘤反应性、重塑免疫微环境以及改善TIL细胞功能等重点方面进行发力。
提高肿瘤反应性,寻找TIL细胞新特异性抗原
TSA可以帮助我们较好定位肿瘤细胞,为了能够增加抗肿瘤反应的TIL细胞数量,我们需要更好地了解哪些抗原可能触发肿瘤反应。和TSA对应的为肿瘤相关抗原(tumor-associated antigen, TAA),即这些抗原并非完全由肿瘤细胞特有,同时正常细胞也会有微量表达,但是在肿瘤细胞增殖时会高表达。现有的技术可以肿瘤测序结果进行深入分析,进而筛选出肿瘤在突变过程中出现的肿瘤特异性新抗原,新抗原的筛选和选择有望进一步富集特异性TIL、增加TIL疗法的肿瘤反应潜力。
针对这一发展趋势,沙砾生物打造的TST hunter®高通量TCR发现平台可以为开发更具肿瘤特异性的TIL疗法开发提供助力:通过丰富的肿瘤和外周血样本资源搭建肿瘤特异性TCR追踪及新抗原发现平台,以实现高通量肿瘤抗原特异性TCR及免疫原性新抗原发现。这一技术平台有望指导和优化可以更好富集肿瘤特异性TIL的工艺,提升TIL的临床疗效,并为后续TIL产品的临床相关性研究奠定坚实的理论和数据支持。
重塑免疫微环境,让TIL细胞更好治疗效果
下一代TIL疗法改善治疗效果的重要途径之一就是重塑肿瘤部位免疫微环境,目前主要的方式包括工程化TIL细胞、TIL联合疗法等。
通过对TIL细胞进行工程化改造和修饰使其分泌免疫刺激性细胞因子,可以促使免疫细胞发挥更好的治疗作用。目前已经进行的临床试验显示通过工程化T细胞使其产生白介素-12(IL-12)可以介导更强的抗肿瘤反应。
另一种重塑免疫微环境的方式则是直接改变肿瘤微环境本身,通过将TIL疗法和其他疗法联合,比如将TIL疗法和溶瘤病毒联合,溶瘤病毒本身会对肿瘤细胞产生杀伤作用进而吸引更多的免疫细胞进入到肿瘤微环境中,TIL疗法与其联合将可以发挥出更好的治疗作用。在一项小鼠模型验证中,可以导致小鼠肿瘤完全消退。
除了上面的这些方法外,还可以通过使用趋化因子招募更多的TIL细胞进入到肿瘤部位,这些方法本身都在于重塑肿瘤部位的免疫微环境,进而让TIL疗法发挥出更好的治疗作用。
改善TIL细胞,让TIL细胞变得更强、更有活性
工程化TIL细胞是改善TIL细胞的主要方式,开发应用于临床的TIL疗法主要聚焦于通过基因编辑等工程化技术让TIL细胞一方面可以消除免疫抑制,另一方面改善T细胞的适应性,使其变得更强大、更有活力。
通过工程化技术对TIL细胞进行修饰,可以使其免受免疫抑制机制影响,目前常用的方式是通过敲除免疫抑制相关基因来达到这一目的,在乳腺癌患者临床试验中证实敲除TIL细胞上的肿瘤生长因子-β(TGF-β)受体基因会让TIL获得更明确的细胞毒性,同时未改变TIL细胞的扩增特性,同时未出现显著的脱靶效应。除此之外,T细胞耗竭也和多种基因有关,通过敲除会导致和T细胞耗竭相关的基因,可以显著提升T细胞的杀伤能力以及体内存活时间。
在改善TIL细胞功能这一路径上,筛选并找到TIL细胞相关的免疫抑制靶点并进行有效敲除至关重要,多家公司也对此进行了探索。为了寻找改善T细胞功能的关键功能性靶点,沙砾搭建了T细胞靶点高通量筛选平台ImmuT Finder®对T细胞进行全基因组筛选,且建立多个体内以及体外肿瘤模型模拟复杂肿瘤微环境对TIL细胞形成的各类挑战,并对筛选出的靶点进行充分验证,以发现可以提高T细胞产品存续和杀伤功能的关键靶点,开发具有自主知识产权的first-in-clas的新型T细胞产品,为实体瘤治疗提供新的突破性细胞疗法。
为了实现TIL中相应靶点的高效稳定基因编辑,沙砾生物构建了病毒稳转株平台StaViral®以及TIL基因敲除体系平台KOReTIL®——StaViral®平台通过经注册临床验证的病毒工艺平台,并获得中国药监局的充分认可,可以有效地将表达的基因转导TIL细胞中,高效稳定同时较传统转染方法有效降低成本;KOReTIL®平台支持短时间内快速进行多个靶点的平行敲除和功能验证,可以精准高效地对TIL相关免疫抑制基因进行敲除。高效的基因编辑平台及稳定的TIL培养工艺,为沙砾更多下一代新型TIL管线的开发奠定了坚实的技术基础。
近年来,细胞与基因治疗( Cell and Gene Therapy,CGT)市场规模持续增加,根据沙利文关于全球CGT治疗市场规模分析及预测,预计2023年全球CGT市场规模将达到88亿美元,2025年全球CGT市场规模将超过220亿美元。
图十三 全球CGT市场规模数据
作为细胞疗法中对抗实体瘤的重要一支疗法,TIL疗法市场也在逐年扩大。近年来中国TIL疗法已经进入快车道,相信在TIL疗法商业化和产业化的道路上,中国TIL疗法公司也将探索并开辟出属于自己的道路。
医疗观察丨TIL疗法引领实体瘤治疗新浪潮,中国企业积极探索疗法产业化道路